Leistungen
Prototyping
Mit Hilfe generativer Fertigung sowie CNC – Zerspanung erstellen wir Muster und Prototypen nach Ihren Vorstellungen. Gemeinsam mit unseren Partnerunternehmen in der Fertigung begleiten wir Sie vollumfänglich bis zur Serie.
Mehr..
Elektronik
Wir bieten normkonforme Hard- und Softwareentwicklung für einfache bis komplexe mechatronische Systeme
Mehr..
Projektkoordination und ‑management
In der interdisziplinären Medizintechnik ist die Kommunikation zwischen den Entwicklungspartnern entscheidend für das Gelingen eines Projektes
Beratung und Zulassung
Wir beraten Sie zu Fragen der Zulassung, Qualitäts- und Risikomanagement und der Interoperabilität (IEEE 11073)
Integrationsdienstleisungen
Per Adapter oder als Partner bei Neu- oder Weiterentwicklungen ihrer Produktlinien – wir integrieren ihr Medizinprodukt nach dem offenen IEEE 11073 SDC Standard in den OP-Geräteverbund der Zukunft
Softwareentwicklung
Ob Embedded- oder Standalone-Software: Die Zweckbestimmung entscheidet darüber, ob Software als (eigenständiges) Medizinprodukt zu klassifizieren ist.
Wir unterstützen Sie ab diesem ersten Punkt und begleiten Sie durch alle Schritte der Entwicklung. Dabei werden Sie in unseren Entwicklungsprozess mit einbezogen, der vorzugsweise agil ist. Agil bedeutet bei uns erstens: Anforderungen sind immer willkommen, zu jedem Zeitpunkt. Und zweitens: Wir liefern zu jedem Zeitpunkt Resultate, die Sie überprüfen können – auch schon während der Entwicklung.
Darüber hinaus entwickeln wir testgetrieben. Das Schreiben vieler automatisierter Tests dient der Stabilität und einem guten Architektur-Design, die für ein Medizinprodukt unentbehrlich sind.
Die für die Softwareentwicklung einschlägigen Normen wie die IEC 62304 müssen bei jedem Entwicklungsprozess beachtet werden. Deswegen steht auch bei der Softwareentwicklung am Schluss eine normkonforme Dokumentation, die bei uns schon während der Entwicklung entsteht.
Elektronikentwicklung
Sie möchten ein Medizinprodukt entwickeln, zulassen oder produzieren? Aufgrund unserer langjährigen Erfahrung können wir sie in jeder Phase des Entstehungsprozesses ihres Produktes unterstützen. Wir nehmen den Faden an der richtigen Stelle auf und begleiten Sie auf Wunsch von der Idee bis zu Zulassung. Unser kompaktes multidisziplinäres Team unterstützt sie dabei, eine schnelle, kostengünstige und qualitativ hochwertige Lösung zu finden.
Prototyping
Unser großvolumiges generatives Fertigungssystem der Firma German Reprap sowie unsere 3‑Achs CNC Fräse der Firma Isel mit moderner Hochfrequenzspindel gewährleisten die schnelle Produktion hochqualitativer Funktionsmuster. Unser Kontaktnetz in der Region umfasst Betriebe für die Computergestützte Zerspanung von Metallbauteilen (CNC), Leiterplattenhersteller sowie Betriebe für generative Fertigungstechnologien, um zu Ihrem Produkt erstklassige Prototypen herzustellen. Die Montage mechanischer Baugruppen sowie das Bestücken elektronische Schaltungen können bei uns vor Ort vorgenommen werden. Wir freuen uns, auch Ihr Konzept in die Realität überführen zu dürfen.
Projektkoordination und ‑management
Die Entwicklung von medizintechnischen Geräte umfasste schon immer eine Vielzahl unterschiedlicher technischer Disziplinen.
Neben der Entwicklung von mechanischen und elektrischen Komponenten hat insbesondere die Softwaretechnik in den letzten Jahren zunehmend einen höheren Stellenwert eingenommen. Durch die Digitalisierung und Vernetzung der unterschiedlichen Systeme sind eine große Anzahl weiterer Disziplinen auf den Plan gerufen worden, die jeweils nur noch von hochspezialisierten IT-Anbietern erfüllt werden können.
Durch die hohe Spezialisierung der Entwicklungsdienstleister auf einzelne Kompetenzen ist es aber zunehmend erforderlich, dass die Entwicklung komplexer medizintechnischer Systeme nur noch in Kooperationen sinnvoll durchgeführt werden können.
Hierzu gehören neben klassischen Ingenieurbüros spezialisierte Softwareanbieter unterstützt durch Hochschulinstitute als auch klinische Partner. Damit diese heterogenen Konsortien effektiv zusammenarbeiten können ist eine erfahrene Projektkoordination essentiell. Die SurgiTAIX hat sowohl im Bereich der Koordination von Forschungsprojekten, als auch Industrieprojekten eine 15-jährige Erfahrung und spricht die „Sprachen“ der verschiedenen Kooperationspartner.
Beratung – RM & QM Dienstleistungen
Qualitäts- und Risikomanagement sind zwei Begriffe die untrennbar mit Medizinprodukten in Verbindung stehen. Entsprechend dem Medizinproduktegesetz ist jeder Hersteller von Medizinprodukten verpflichtet, für jedes seiner Produkte eine technische Dokumentation nachzuweisen. Diese Dokumentationen müssen entsprechend einem Qualitätsmanagementsystem erstellt und den gesamten Lebenszyklus des Produktes aufrecht erhalten werden.
Im Einzelnen müssen insbesondere die folgenden Gesetze, Normen und Richtlinien eingehalten werden:
- Medizinproduktegesetz (MPG)
- Richtlinie 93/42/EWG und MDR (Medical Device Regulation)
- Qualitätsmanagement nach DIN EN ISO 13485
- Risikomanagement nach DIN EN ISO 14971
- Elektrische Sicherheit DIN EN 60601–1
- Gebrauchstauglichkeitstest nach DIN EN 60601–1‑6
- Softwareentwicklung nach DIN EN 60601–1‑4 und DIN EN 62304
Die SurgiTAIX AG bietet insbesondere für Neu- und Ausgründungen hierfür ein angepasstes Beratungspaket an. Angefangen vom Aufbau eines QM-Systems, der Unterstützungen beim Erstellen von technischen Dokumentationen, bis hin zur Begleitung bei der Zulassung bieten wir alle Beratungsleistungen aus einer Hand an.
Über die reinen Beratungsleistungen hinaus bieten wir Schulungen und Vorträge zu folgenden Themen an:
- Qualitätsmanagement für Medizinprodukte
- Risikomanagement für Medizinprodukte
- Technische Dokumentation
- Richtlinienkonforme Entwicklung von Elektronik, Soft- und Hardware
- Elektrische Sicherheit
Bei unseren Dienstleistungen stehen höchste Qualität und Sicherheit im Vordergrund. Profitieren Sie von unserer langjährigen Erfahrung im Bereich Qualitäts- und Risikomanagement für Ihre Produkte.
Risikomanagementsoftware CARAD
Risikomanagement bei Medizinprodukten
Für die Anwendung des Risikomanagements und somit der Risikoanalyse speziell auf Medizinprodukte gilt die Norm DIN EN ISO 14971. Nach dieser muss für jedes Medizinprodukt eine Risikomanagement-Akte angelegt werden, in der die Risikoanalyse inklusive Risikobewertung und Risikokontrolle, sowie Informationen aus den Lebenslaufphasen nach der Auslieferung des Produktes zusammengefasst und dokumentiert werden. Dabei muss sichergestellt werden, dass alle verantwortlichen Personen auch über das dazu notwendige Fachwissen verfügen und die nötige Erfahrung besitzen. Dies ist ebenfalls in der Risikomanagement-Akte zu dokumentieren.
Die Risikosoftware CARAD
CARAD ist eine Software, die speziell entwickelt wurde, um den Prozess des Risikomanagements zu vereinfachen. Die Eingabe von Risikoanalysen mit CARAD erfolgt prozessorientiert auf Basis der Fehler– Möglichkeits- und Einfluß– Analyse (FMEA). Parallel hierzu kann zu jederzeit eine entsprechende Fehler- Baum- Analyse (FBA) durchgeführt werden. Durch die Kombination aus FMEA und FBA können nicht nur die potentiellen Schwachstellen des Systems einfach erkannt, sondern auch deren Ursachen problemlos zugeordnet werden.
Um die Übersichtlichkeit zu erhöhen, werden thematisch zusammenhängende Prozessschritte in Prozessen gruppiert. Prozesse können zusammen mit weiteren Prozessschritten zu übergeordneten Prozessen gruppiert werden, so dass am Ende eine Baumstruktur mit Prozessen als Ästen und Prozessschritten als Blättern entsteht.
Der mit CARAD erzeugte Risiko-Analyse-Report entspricht in seiner Form einem FMEA-Formblatt. Für jeden Fehler werden alle Kombinationen aus Ursache und Konsequenz ermittelt und in eine separate Zeile der Tabelle unterhalb des aktuellen Arbeitsschrittes mit den korrespondierenden Risikozahlen eingetragen. Die zur Berechnung der RPZ (Risikoprioritätszahl) benutzten Risikozahlen sind dabei sowohl von den generischen Ursachen, als auch von vorhergehenden und nachfolgenden Fehlern abhängig.
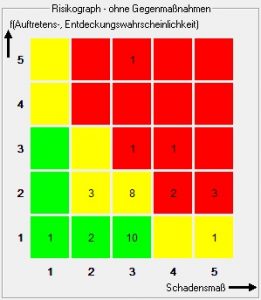
Die Ausgabe des Risiko-Analyse-Reports erfolgt im PDF-Format.
CARAD ist lauffähig unter Windows 7, 8.x und 10.
CARAD wird von den folgenden Windows 10 Editionen unterstützt: Windows 10 Pro und Windows 10 Enterprise.
Weitere informationen
Informationen zur Evaluierung und Vergleich mit anderen Tools
Weitere Informationen zur CARAD-Software (Download Flyer)
Ergänzende Lektüre
Als einführende Lektüre empfehlen wir das Buch von Prof. Dr. Jürgen P. Bläsing „Medizinprodukte: Risikomanagement im Lebenszyklusmodell“.
Download der Software
Bitte schreiben sie uns unverbindlich an: office[at]surgitaix.com. Wir schicken Ihnen gerne eine kostenlose Testversion zu.
Integrationsdienstleisungen
Die SurgiTAIX AG befasst sich seit knapp 15 Jahren mit der offenen, herstellerübergreifenden Vernetzung von Medizingeräten. In den Forschungsprojekten OrthoMIT und OR.NET wurden verschiedene Standards für die Vernetzung von Medizingeräten definiert und in die Standardisierung überführt. Das Ergebnis waren die Standards der IEEE 11073 SDC Normenfamilie, namentlich BICEPS, MDPWS sowie Architecture Binding. In den Forschungsprojekten ZiMT, MoVE, MOMENTUM und PriMed wurden Anwendungsszenarien sowie die Zulassbarkeit und Testverfahren erforscht. Die Ergebnisse dieser Forschungsprojekte fließen in die Definition der sog. Participant Key Purposes ein, welche sich derzeit in der Ballotting Phase der Standardisierung befinden. Die PKPs legen die Anforderungen an Geräte abhängig von ihrer Funktion fest, beispielsweise an Geräte die von außen gesteuert werden können oder Alarme ausgeben oder verarbeiten. Ebenso werden derzeit die sog. Device Specializations hergeleitet, in denen die Anforderungen an bestimmte Geräteklassen wie HF-Geräte, Spritzenpumpen oder OP-Tische gesammelt werden. Die Standardisierung wurde und wird von der SurgiTAIX AG aktiv begleitet.
sdcX – Die kommerzielle SDC Bibliothek
Daneben ist die SurgiTAIX AG seit Jahren im Bereich der SDC-Bibliotheken und ‑softwarestacks aktiv. Ein solcher Stack ermöglicht es einem Medizingerätehersteller ohne tiefgreifende Kenntnis der Standards sein Gerät über SDC zu vernetzen. Der Stack übernimmt dabei die Rolle einer Kommunikationsbibliothek und erfüllt weite Teile der Anforderungen der IEEE 11073 SDC Normenfamilie. Bisherige, öffentlich verfügbare SDC Stacks wie die von SurgiTAIX entwickelten SDCLib/C (https://github.com/surgitaix/sdclib) und SDCLib/J (https://bitbucket.org/surgitaix/sdclib) waren primär für die Benutzung in Demonstratoren und zur Technologieevaluation ausgelegt. Eine Nutzung in kommerziellen Produkten war auf Grund der fehlenden Dokumentation und Risikobetrachtung nur schwer möglich. Die von SurgiTAIX neu entwickelte C++-Bibliothek sdcX ist der erste Stack, die die Anforderungen für den kommerziellen Betrieb betrachtet und erfüllt. sdcX implementiert weite Teile der drei 11073 SDC Kernstandards sowie Teile der sich derzeit in Entwicklung befindlichen PKP-Unterstandards.
Durch Nutzung aktueller Technologien und Programmiermethoden wird eine hohe Performance bei gleichzeitig moderatem Speicher- und Resourcenverbrauch ermöglicht. Die Bibliothek kann unabhängig von der Arbeitsweise der Gerätes oder Mehrwertdienstes genutzt werden, da sie unterschiedliche Ablaufmodelle (Callbacks, asynchrone Programmierung, Thread pooling) unterstützt.
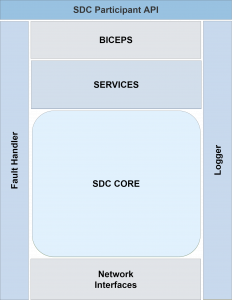
Ein Fokus während der Entwicklung wurde auf die Erweiterbarkeit der Bibliothek gesetzt – das X im Namen steht für eXtensible. Durch einen erweiterbaren Logger können von der Bibliothek anfallende Logs direkt in die eigenen, gerätespezifischen Logger integriert werden. Ebenso können eigene Auswertungen durch eine Vielzahl von abonnierbaren Notifications erfolgen, beispielsweise beim Eingang einer neuen Nachricht eines bestimmten Typs. Dies ermöglicht eine Nutzung der Bibliothek in diversen Anwendungsfällen und ‑feldern.
Die Bibliothek unterstützt gängige ARM- und x86-Systeme mit Windows oder Linux als Betriebssystem. Crosscompiler für Buildroot oder Yocto Linux können durch den verwendeten, CMake-basierten Buildprozess besonders schnell integriert werden. Zum Testen der Bibliothek auf der Zielplattform steht eine umfassende Testsuite auf Anfrage zur Verfügung. In dieser werden alle Teilbereiche der Standards und der Bibliothek getestet und ausgewertet.
Neben einer umfangreichen Dokumentation wird auch eine umfassende Risikoanalyse sowie eine IEC 62304 konforme Entwicklungsdokumentation bereitgestellt.
Bereits während der Entwicklung wurden Anforderungen an die IT-Sicherheit durch einen Securityprozess ermittelt und betrachtet. Diese Dokumentation des Prozesses sowie der betrachteten Risiken kann in eine Dokumentation für die derzeit geltende „FDA Premarket Submission for Management of Cybersecurity in Medical Devices“ integriert werden. Der Status der SOUP Komponenten wird kontinuierlich überprüft.
Die Anforderungen an Medizingeräte werden immer höher, ebenso steigen die Anforderungen der Medizingeräte an der Infrastruktur. Vor allem fehlende Betrachtung von Echtzeitanforderungen sowie störende Kabel erschweren oder verhindern innovative Anwendungsfälle. Zu diesem Zweck soll im Forschungsprojekt 5G-FORUM die Bibliothek um die Unterstützung für echtzeitfähige 5G-Vernetzung mit TSN erweitert werden. Dies ermöglicht mittelfristig die Nutzung der Bibliothek in kritischen Bereichen wie der Ansteuerung von Steuerelektroniken, Bildgebung oder in der Robotik.
Interesse geweckt? Kontaktieren Sie uns für mehr Informationen
